- Arthropoda (Gliederfüßer)
- Mantodea (Gottesanbeterinnen)
-
Insecta

Fluoreszenz und Farbsensitivität

Wie alle Skorpione fluoresziert auch Parabuthus villosus unter UV-Licht
Das natürliche Vorkommen von Fluoreszenzen verschiedener Ausprägungen ist in unterschiedlichsten Organismengruppen wie Tieren, Pilzen, Bakterien, Algen und Pflanzen wohlbekannt. So erzeugt zum Beispiel die Qualle Aequorea victoria durch interne Prozesse blaues Licht, welches wiederum das Protein GFP zur Fluoreszenz und damit der Emission grünen Lichtes anregt (Chalfie, 1995), während diverse Riff-Fische über lokale, rote Fluoreszenz an Augen, Kopf und Flossen verfügen (Michiels et al., 2008). Auch innerhalb der Arachnida zeigt sich dieses Phänomen, ein prominentes Beispiel sind die meist auffällig gefärbten Springspinnen, bei denen z.B. Cosmophasis umbratica eine geschlechtsspizifische und nur die Weibchen dieser Art betreffende grüne Fluoreszenz aufweist (Lim et al., 2007). Die Fluoreszenz der Skorpione ist insofern bemerkenswert, als dass sich dieser faszinierende Effekt ausnahmslos durch alle bekannten, rezenten Arten zieht und nicht nur ein lokales Phänomen ist, sondern mit Ausnahme der Spitze des Aculeus und der Linsen der Median- und Lateralaugen die gesamte sklerite Cuticula-Oberfläche bestrifft. Es wundert daher wenig, dass die Fluoreszenz der Skorpione Ziel vieler Forschungsbemühungen ist und es zahlreiche Erklärungsversuche für die Entstehung und Funktion eben dieser gibt.
Die Fluoreszenz beschreibt im Falle von Skorpionen die Abstrahlung von grün-blauen Licht bei Bestrahlung von UV-Licht. Sie prägt sich mit der Aushärtung der Cuticula aus, was leicht einsehbar ist, da frisch gehäutete Skorpione nicht fluoreszieren und ihre Fluoreszenz mit zunehmender Härtung der Cuticula zunimmt, und ist permanent, besteht also auch nach dem Tod des Skorpions weiter. Es wurde jedoch experimentell bestätigt, dass die Fluoreszenz der Cuticula durch Bestrahlung mit intersiver UV-Strahlung drastisch reduziert werden kann (Kloock, 2009).
Die Cuticula des Skorpions (Beispiel-Stärken anhand von Hadrurus arizonensis) besteht distal beginnend aus Epicuticula (0,3 µm), Exocuticula (13 µm) und der Endocuticula (65 - 85 µm) (Filshie und Hadley, 1979). Alle dieser Schichten können wiederum in Subschichten unterteilt werden, von denen für die Fluoreszenz nur die Unterteilung der Exocuticula in hyaline Exocuticula (7,5 µm) und Mesocuticula (5,5 µm) (Filshie und Hadley, 1979) von Bedeutung ist (Hjelle, 1990).
Die Fluoreszenz der Skorpione wurde bisher auf zwei unterschiedliche, in Alkohol lösliche und jeweils im Aushärtungsprozess in der hyalinen Exocuticula eingelagerte Verbindungen zurückgeführt: Beta-Carbolin (Stachel et al., 1999) und 4-Methyl-7-Hydroxycoumarin (Frost et al., 2001) - letzteres ist die erste Entdeckung einer Coumarinverbindung im Stamm der Arthropoden und die Dritte in der Tierwelt, Coumarinverbindungen sind fast ausschließlich bei Pflanzen anzutreffenden. Es ist anzunehmen, dass wegen dessen geringer Konzentration Beta-Carbolin nicht allein für eine signifikante Fluoreszenz sorgen kann (Stachel et al., 1999).
Beide Verbindungen strahlen unter Anregung durch UV-Licht im blauen Bereich ab, die Intensitätsmaxima der Emission liegen im Falle beider Verbindungen zwischen 440 und 450 nm, was sich mit dem Maximum der Emission von 445 nm einer aus der Exuvie hergestellten Alkohollösung deckt (Stachel et al., 1999; Frost et al., 2001), jedoch unterhalb der tatsächlichen grün-blauen Emission der Skorpionexuvie liegt, welche ihr Emissionsmaximum abhängig von der Art des Skorpiones bei oder leicht unterhalb von 500 nm findet (Kloock, 2008). Stachel et al., 1999, nehmen daher an, dass entweder der primäre Fluoreszenz-Erreger in der Alkohollösung nicht mit dem in der Exuvie übereinstimmt, oder die Unterschiede in der abgestrahlten Wellenlänge durch lokale Begebenheiten innerhalb der Exuvie zu Stande kommen.
Es gibt zahlreiche mögliche Erkärung für dieses Phänomen, auch wenn viele Hypothesen durch die Tatsache erschwert werden, dass die rezenten Skorpione primär nachtaktiv sind und die UV-Abstrahlung des Nachthimmels um das Zehntausendfache niedriger ist als am Tag (Johnsen et al., 2006). Die möglichen Erklärungen umfassen u.A. das Anziehen von Beutetieren, die Geschlechts- und Artdifferenzierung, den Schutz vor UV-Einstrahlung und einen sensorische Apparatus für die Wahrnehmung von UV-Licht ansich - aber natürlich ist es ebenso möglich, dass die für die Ausbildung der Skorpioncuticula verwendeten Substanzen Fluoreszenz aufweisen ohne dass diese eine Funktion hat. Die ersten beiden Hypothesen wurden bereits weitestgehend widerlegt. So zeigte sich, dass Fluginsekten fluoreszierende Skorpione eher meiden als aufsuchen (Kloock, 2005) und es ließ sich bei untersuchten Arten nur ein sehr schwacher Geschlechtsunterschied in der Charakteristik des abgestrahlten Lichtes der Fluoreszenz feststellen, womit Skorpione eine unwahrscheinlich feine Wellenlängenauflösung (2 nm) zur Unterscheidung von Geschlechtern benötigen würden (Kloock, 2008). Auch wenn die außerartlichen Unterschiede in der Wellenlänge des abgestrahlten Lichtes minimal größer sind, so scheint auch dies aus selbigem Grund unwahrscheinlich (Kloock, 2008).
Für die Betrachtung der Hypothese, dass die Fluoreszenz Teilfunktion eines UV-Sensors ist, sollte man insbesondere den Bezug zu den optischen Fähigkeiten und der Farbsensitivität der Skorpionaugen herstellen.
Zur Untersuchung der Spektralsensitivitäten der optischen Sinne des Skorpions wurden zum einen physiologische als auch Verhaltensexperimente durchgeführt. Es wurden elektrische Signale im Nervensystem des Skorpions gemessen, die bestimmten, wieviele Lichtblitze einer gegebenen Wellenlänge nötig waren, um eine neuronale Schwellenreaktion auszulösen - die Sensitivität wird angegeben als der Kehrwert dieser Anzahl pro Blitzenergie (E/i) (Machan, 1968). An Dunkelheit gewöhnte Median- und Lateralaugen weisen einen bis auf absolute Intensität ähnlichen Verlauf bei Wellenlängen über 430 nm und deutliche Unterschiede unterhalb von 430 nm auf (Machan, 1968). Während die Sensitivität beider Augentypen bei 600 nm nahe null liegt, steigt diese in beiden Fällen auf ein Maximum bei knapp über 500 nm und fällt bis 430 nm stetig ab (Machan, 1968). Die Sensitivität der Medianaugen sinkt mit fallender Wellenlänge weiter und ist bei 370 nm verschwindend gering, die der Lateralaugen steigt jedoch wieder drastisch an und erreicht einen hohes Maximum bei 370 nm (Machan, 1968). Der folgende Graph verdeutlicht diese relativen Sensitivitäten, macht jedoch keine Aussage über absolute Werte.
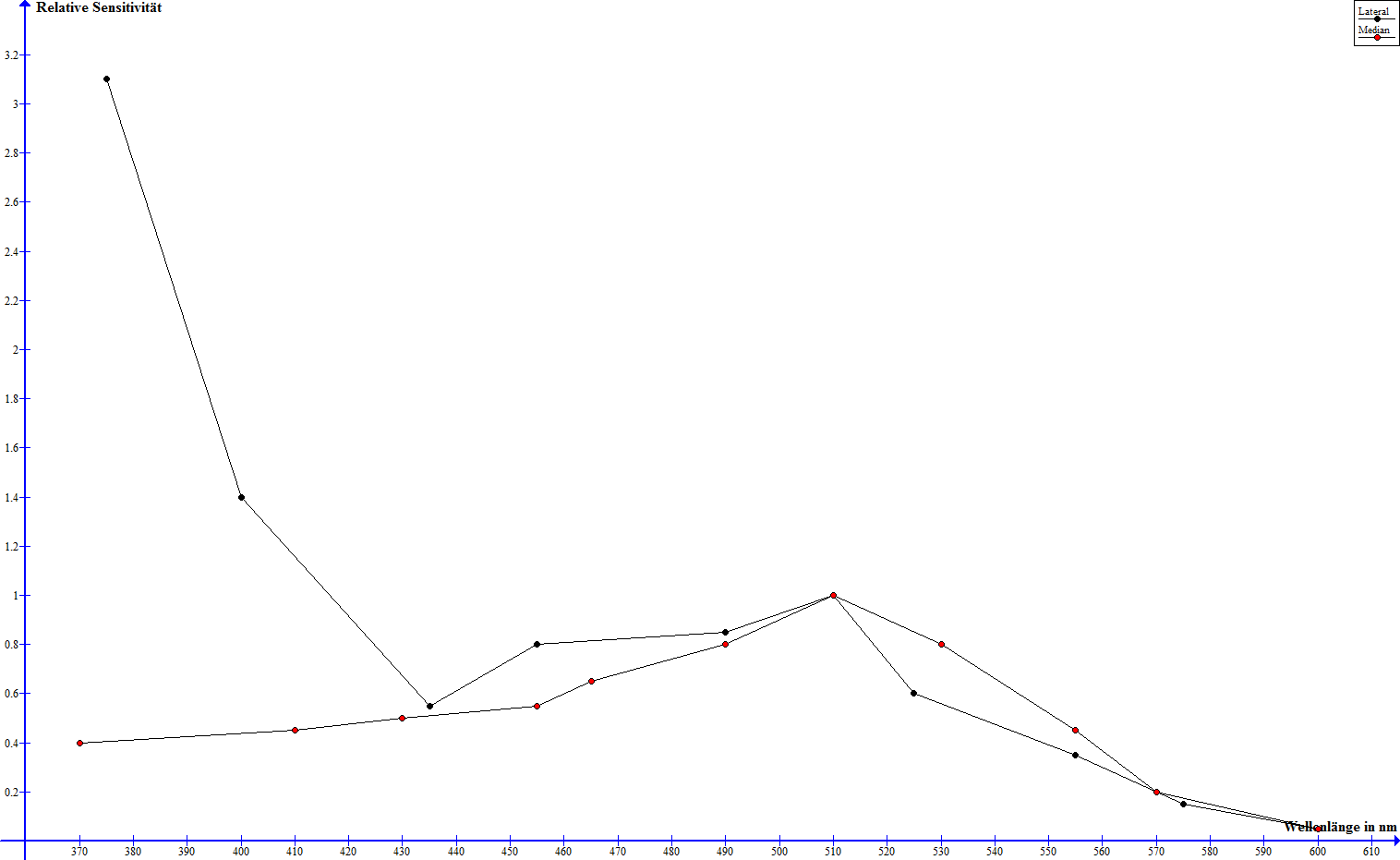
Die Spektral-Sensitivitäten von Median- und Lateralaugen nach Machan, 1968, normalisiert zu 1 bei 509 nm - zum Vergrößern bitte anklicken
Während die Medianaugen in der Nachtphase also ihre beste Wahrnehmung bei grünem Licht erreichen, so sind die Lateralaugen besonders sensitiv auf grünes und in extremem Umfang UV-Licht. Gelbes und rotes Licht werden hingegen kaum bis nicht wahrgenommen.
Die große Sensitivität der Lateralaugen im ultravioletten Bereich sinkt überdurchschnittlich stark noch weit unter das Sensitivitätsmaximum im grünen Bereich, wenn die Augen zuvor an Licht gewöhnt wurden, im restlichen Wellenlängenbereich ist der Rückgang dafür relativ gleichmäßig, ebenso im Fall der Medianaugen über das gesamte Spektrum (Machan, 1968). Dies lässt sich gut mit dem Absorptionsspektrum der Pigmentgranulen in Median- und Lateralaugen vergleichen. Es zeigt sich erwartungsgemäß, dass die Absorption der Pigmente in den Medianaugen über das ganze betrachtete Spektrum relativ konstant ist, während die Pigmente in den Lateralaugen besonders stark im UV-Bereich absorbieren und die Absorption mit steigender Wellenlänge mehr und mehr nachlässt (Machan, 1968).
Diese Erkentnisse wurden durch Verhaltensexperimente bestätigt. Blass und Gaffin, 2007, untersuchten das Bewegungs- und Aufenthaltsverhalten von Skorpionen unter Einstrahlung von Licht verschiedener Wellenlängen. Es stellte sich heraus, dass Tiere, denen ein beschatteter Rückzugsbereich angeboten wurde, am wenigsten Zeit im UV-Licht verbrachten, leicht mehr im grünen Licht und am meisten Zeit im unbeschatteten Bereich bei Rotlicht und keinerlei Lichteinstrahlung. In der gleichen Versuchsreihe, jedoch ohne Rückzugsmöglichkeit, wurde gezeigt, dass Tiere unter Einstrahlung innerhalb der ersten 5 Minuten der Testreihen eine signifikant höhere Bewegungsfrequenz im Falle von UV-Licht zeigten als bei grünem Licht, welche wiederum oberhalb der Bewegungsfrequenz bei rotem und keinem Licht lag. Diese Erkenntnisse wurden bei nicht komplett an Dunkelheit gewöhnten Tieren durchgeführt und es ist daher erstaunlich, dass die Tiere bei UV-Licht eine höhere Aktivität und Aversion gegen Licht aufwiesen, als bei grünem Licht, da die Augen im Grünbereich unter diesen Bedingungen ihre höchste Sensitivität aufzeigen. Da Skorpionaugen nur eine Art von Photorezeptor besitzen (Brownell, 2001), jedoch offenbar verschiedene Wellenlängen differenzieren können, ist anzunehmen, dass die Tiere durch Intensitätenvergleich z.B. mittels des extraokularen Lichtsinns im Metasoma, welcher seine höchste Sensitivität im grünen Bereich findet (Rao und Rao, 1973), verschiedene Wellenlängen differenzieren können.
Um zu untersuchen, ob ihre Fluoreszenz zur Detektion von UV-Strahlung beiträgt, verglichen Kloock et al., 2010, ob sich das Verhalten von Skorpionen unter Einstrahlung von Licht verschiedener Wellenlängen ändert, wenn die Fluoreszenz der Tiere gesenkt wird. Die Intensität der Einstrahlung wurde dabei sehr niedrig an den Abendhimmel angepasst, für das menschliche Auge war keine sichtbare Fluoreszenz wahrnehmbar. Es stellte sich heraus, dass bei Einstrahlung von rein infrarotem Licht und weiter Einstrahlung von infrarotem und weißem Licht keine signifikante Verhaltensänderung der Tiere mit gewöhnlicher und reduzierter Fluoreszenz eintrat. Bei Bestrahlung mit infrarotem und ultraviolettem Licht steigerte sich die Aktivität der Tiere jedoch signifikant, wenn ihre eigene Fluoreszenz gesenkt wurde, was dafür spricht, dass die Fluoreszenz für die Detektion von UV-Licht genutzt wird (Kloock et al., 2010).
Gaffin et al., 2012, führten ein ähnlich ausgerichtetes Experiment durch, in dem sie die Bewegungsfrequenzen von unbehandelten Skorpionen unter ultraviolettem und grünem Licht mit solchen verglichen, deren Median- und Lateralaugen abgeklebt wurden. Es zeigte sich, dass manipulierte Tiere eine deutlich niedrigere Aktivität aufwiesen als die unmanipulierten Tiere. Jedoch verringerte sich die Bewegungsfrequenz und auch die Anzahl der Tiere, die sich überhaupt bewegten, absolut viel stärker im Fall des grünen Lichtes, als bei Bestrahlung mit UV-Licht. Dies spricht also dafür, dass die Tiere trotz verdunkelten Augen noch ausreichend viel UV-Strahlung wahrnehmen können und ist ein gutes Indiz für die Theorie, dass der gesamte Körper durch seine Fluoreszenz ein UV-Kollektor ist, der diese Strahlung in grünes Licht umwandelt, bevor sie durch den extraokularen Lichtsinn im Metasoma aufgenommen wird - dies würde die Aufnahme von UV-Strahlung im Vergleich zur direkten Aufnahme durch die Augen wegen der großen Oberfläche um das Tausendfache erhöhen (Gaffin et al., 2012).
Quellenangaben
Blass, G.R.C., Gaffin, D.D. (2008). Light wavelength biases of scorpions. Animal Behaviour 76, 365-373.
Brownell, P.H. (2001). Sensory ecology and orientational behaviors. In P.H. Brownell & G.A. Polis (ed.). Scorpion Biology and Research. Oxford University Press, Oxford.
Chalfie, M. (1995). Green fluorencet protein. Photochemistry and Photobiology 62, 651-656.
Frost, L.M., Butler, D.R., O’Dell, B. and Fet, V. (2001). A coumarin as a fluorescent compound in scorpion cuticle. In V. Fet and P.A. Selden (eds). Scorpions 2001 In Memoriam Gary A. Polis. British Arachnological Society, 363-368.
Filshie, B.K. und Hadley, N.F. (1979). Fine structures of the cuticule of the desert scorpion, Hadrurus arizonensis. Tissue and Cell 11(2), 248-262.
Gaffin, D.G., Bumm, L.A., Taylor, M.S., Popokina, N.V., Mann, S. (2012). Scorpion fluorescence and reaction to light. Animal Behaviour 83, 429-436.
Hjelle, J.T. (1990). Anatomy and morphology. In G.A. Polis (ed.). The biology of scorpions. Stanford University Press, Standford, California.
Johnsen S., Kelber A., Warrant E., Sweeney A.M., Widder E.A., Lee Jr. R.L., Hernández-Andrés J. (2006). Crepuscular and nocturnal illumination and its effect on color perception by the nocturnal hawkmoth Delilephila elpenor. The Journal of Experimental Biology 209, 789-800.
Kloock, C.T. (2005). Aerial insects avoid fluorescing scorpions. Euscorpius 21, 1–7.
Kloock, C.T. (2008). A comparison of fluorescence in two sympatric scorpion species. Journal of Photochemistry and Photobiology B: Biology 91, 132–136.
Kloock, C.T. (2009). Reducing scorpion fluorescence via prolonged exposure to ultraviolet light. The Journal of Arachnology 37, 368–370.
Kloock, C.T., Kubli, A., Reynolds, R. (2010). Ultraviolet light detection: a function of scorpion fluorescence. Journal of Arachnology 38, 441-445.
Lim, L.M.M., Land, M.F., Li, D. (2007). Sex-Specific UV and Fluorescence Signals in Jumping Spiders. Science 315, 481.
Machan, L. (1968). Spectral sensitivity of scorpion eyes and the possible role of shielding pigment effect. J. Exp. Biol. 49, 95-105.
Michiels, N., Anthes, N., Hart, N., Herler, J., Meixner, A., Schleifenbaum, F., Schulte, G., Siebeck, U., Sprenger, D., Wucherer, M. (2008). Red fluorescence in reef fish: A novel signalling mechanism?. BMC Ecology 8, 1635-1655.
Rao, G., Rao, K.P. (1973). A metasomatic neuronal photoreceptor in the scorpion. Journal of Experimental Biology 58, 189-196.
Stachel, S.J., Stockwell, S.A., Van Vranken, D.L. (1999). The fluorescence of scorpions and cataractogenesis. Chemistry & Biology 6, 531-539.
F. Schmitz, verfasst 2012